エプキンリ[一般名:エプコリタマブ(遺伝子組換え)](以下、本剤)は、ジェンマブ社が開発した技術DuoBody®を用いて作製された CD3及びCD20に結合するヒト化免疫グロブリン(Ig)G1二重特異性モノクローナル抗体であり、DuoBody分子の作製に必要な相補的変異の1つを含むヒト化IgG1λ抗CD3εmAb及びヒトIgG1κ抗 CD20 mAb IgG1-7D8の制御されたFabアーム交換により得られる。本剤は、T細胞の細胞膜上に発現するCD3とB細胞性腫瘍の細胞膜上に発現するCD20の両者に結合することによって、CD20陽性の腫瘍細胞を傷害すると考えられる。CD20はB細胞に特異的に発現し、B細胞性リンパ腫の90%以上で発現が認められている。
本剤の対象疾患は、再発又は難治性の大細胞型B細胞リンパ腫(LBCL)及び濾胞性リンパ腫(FL)(Grade3BのFL(FL3B)に限る)であり、LBCL[びまん性大細胞型B細胞リンパ腫(DLBCL)、原発性縦隔B細胞リンパ腫 (PMBCL)、高悪性度B細胞リンパ腫(HGBCL)等を含む]及びFLはB細胞性非ホジキンリンパ腫(BNHL)に属する。三次治療以降の再発又は難治性のLBCL及びFL3Bに対して標準的な治療法は確立しておらず、新たな治療法が求められている。
本剤の臨床開発では、再発性、進行性又は難治性のB-NHLを有する外国人患者を対象とした海外第Ⅰ/Ⅱ相試験(GCT3013-01試験)が2018年6月に開始され、用量漸増パート(以下、第Ⅰ相パート)では本剤の単剤療法による忍容性が確認され、安全性、有効性及び曝露―応答関係のデータに基づき、固定用量のプライミングドーズ0.16mg、中間ドーズ0.8mg及びフルドーズ48mgを第Ⅱ相試験推奨用量(RP2D)と決定し、用量拡大パート(以下、第Ⅱ相パート)では三次治療以降の再発又は難治性のアグレッシブB細胞性非ホジキンリンパ腫(aNHL)(DLBCL、HGBCL、PMBCL及びFL3B)患者に対する本剤の単剤療法による有効性及び安全性が確認された。これらの結果に基づき、本剤は2023年5月に米国で「2つ以上の全身療法後の再発又は難治性のびまん性大細胞型B細胞リンパ腫(not otherwise specified)(インドレントリンパ腫からの組織学的形質転換を含む)及び高悪性度B細胞リンパ腫」を効能又は効果として承認された。
国内では再発又は難治性のB-NHLを有する日本人患者を対象とした国内第Ⅰ/Ⅱ相試験(GCT3013-04試験)が2020年8月に開始され、第Ⅰ相パートでは本剤の単剤療法による忍容性が確認され、外国人患者と同様のRP2Dを選択した第Ⅱ相パートでは三次治療以降の再発又は難治性のDLBCL患者に対する本剤の単剤療法による有効性及び安全性が確認された。これらの結果に基づき、本剤は「再発又は難治性の大細胞型B細胞リンパ腫(びまん性大細胞型B細胞リンパ腫、高悪性度B細胞リンパ腫、原発性縦隔大細胞型B細胞リンパ腫)」及び「再発又は難治性の濾胞性リンパ腫」を効能又は効果として2023年9月に承認を取得した。
作用機序
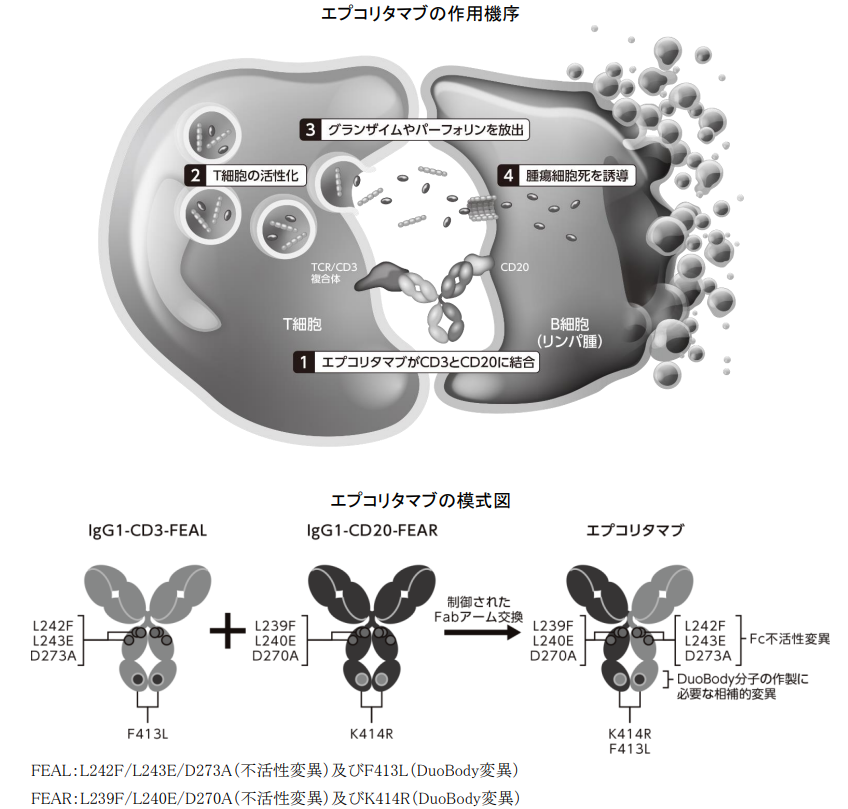
エプコリタマブは、ジェンマブ社が開発した技術DuoBody®を用いて作製されたT細胞表面抗原CD3及びB細胞表面抗原CD20のエピトープに特異的に結合するヒト化IgG1二重特異性抗体であり、DuoBody分子の作製に必要な相補的変異(F413L又はK414R)のそれぞれ1つを含むヒト化IgG1λ抗CD3εmAb(IgG1-CD3-FEAL, 3005a)及びヒトIgG1κ抗CD20mAbIgG1-7D8(IgG1-CD20-FEAR,3001d)の制御されたFabアーム交換により得られる。
エプコリタマブは、CD20発現腫瘍細胞に対するT細胞介在性の細胞傷害を誘導する。CD20特異的な細胞傷害は、T細胞上のCD3と腫瘍細胞(B細胞)上のCD20に同時に結合することによって達成され、T細胞の活性化及び増殖並びにCD4陽性及びCD8陽性T細胞からの細胞傷害性顆粒の放出をもたらす。
製品情報
| 商品名 | エプキンリ皮下注4mg/エプキンリ皮下注48mg |
| 一般名 (洋名) | エプコリタマブ (Epcoritamab) |
| 承認年月日 | 2023 年 9 月 25 日 |
| 発売年月日 | |
| メーカー | ジェンマブ株式会社 |
| 名前の由来 | 有効成分であるepcoritamabに由来する。 |
| ステム | モノクローナル抗体:-mab |
[こちらも参照:ステムで薬の名前を暗記!【一覧リスト】薬が覚えられない人必見!]
効能又は効果
〇以下の再発又は難治性の大細胞型B細胞リンパ腫
びまん性大細胞型B細胞リンパ腫
高悪性度B細胞リンパ腫
原発性縦隔大細胞型B細胞リンパ腫
〇再発又は難治性の濾胞性リンパ腫
1.1 本剤は、緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に対して、十分な知識・経験を持つ医師のもとで、本剤の使用が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
1.2 重度のサイトカイン放出症候群があらわれることがあり、死亡に至る例が報告されている。特に治療初期は入院管理等の適切な体制下で本剤の投与を行うこと。また、サイトカイン放出症候群に対する前投与薬の投与等の予防的措置を行うとともに、観察を十分に行い、異常が認められた場合には、製造販売業者が提供するサイトカイン放出症候群管理ガイダンス等に従い、適切な処置を行うこと。
1.3 免疫エフェクター細胞関連神経毒性症候群があらわれることがあり、死亡に至る例が報告されている。観察を十分に行い、異常が認められた場合には、製造販売業者が提供する免疫エフェクター細胞関連神経毒性症候群管理ガイダンス等に従い、適切な処置を行うこと。
本剤の成分に対し過敏症の既往歴のある患者
用法及び用量
通常、成人にはエプコリタマブ(遺伝子組換え)として、28日間を1サイクルとして、1サイクル目は1日目に1回0.16mg、8日目に1回0.8mg、15日目及び22日目に1回48mgを皮下投与する。その後は1回48mgを、2及び3サイクル目は1、8、15、22日目、4から9サイクル目には1、15日目、10サイクル目以降は1日目に皮下投与する。
・本剤による治療は、抗CD20モノクローナル抗体製剤を含む少なくとも2つの標準的な治療が無効又は治療後に再発した患者を対象とすること。
・〈再発又は難治性の濾胞性リンパ腫〉十分な経験を有する病理医により、Grade 3Bと診断された患者に投与すること。
代謝・代謝酵素について
本剤は一般的なタンパク異化経路により小ペプチド及びアミノ酸に代謝されると推定される
食事の影響
該当資料無し
副作用(抜粋)
重大な副作用として、サイトカイン放出症候群、免疫エフェクター細胞関連神経毒性症候群、感染症、血球減少、腫瘍崩壊症候群、進行性多巣性白質脳症(PML)が報告されている。
主な副作用(10%以上)は、注射部位反応(注射部位紅斑、注射部位疼痛、注射部位そう痒感、注射部位肥厚、注射部位炎症、注射部位発疹、注射部位内出血、注射部位腫瘤、注射部位腫脹、注射部位蕁麻疹を含む)、発熱(体温上昇を含む)であった。
情報更新日:2023年11月