開発の経緯について
アルツハイマー病(AD)は高齢者の認知症で最もよくみられる疾患であり、記憶およびその他の認知機能、行動、並びに日常生活機能が緩徐に障害される進行性の神経変性疾患である。国内では、2012年時点の認知症患者総数が約462万人、軽度認知障害(MCI:mild cognitive impairment(軽度認知障害))患者数が約400万人であり、65歳以上の高齢者の約25%が認知症またはその予備群であると推計されている。高齢化の進展に伴い、この数はさらに増加し、2025年には国内で700万人以上が認知症となり、その2/3以上がアルツハイマー型認知症であると想定されている。
レケンビ点滴静注(有効成分:レカネマブ[遺伝⼦組換え]、以降本剤)は、早期AD(アルツハイマー病による軽度認知障害[MCI due to AD]および軽度認知症)を対象に開発されたヒト化抗ヒト可溶性アミロイドβ凝集体モノクローナル抗体である。
アミロイドβ(Aβ)は、単量体(モノマー)、小さな二量体および三量体から、より大きなオリゴマーおよびプロトフィブリルまでの可溶性Aβ凝集体、そして不溶性のフィブリルと、さまざまな形態で存在する。このうちAβプロトフィブリルがシナプス機能を障害し、神経細胞毒性を示すことが示唆されており、これがADの進行に伴って臨床的に観察される認知機能低下、そして最終的には認知症を引き起こすと考えられている。
本剤は、ADの病理の一つであるAβのうち、毒性が示唆されているAβプロトフィブリルに対して選択的に結合し、脳脊髄液(CSF)中への排出を介して脳内のAβプロトフィブリルおよびアミロイド斑(Aβプラーク)を減少させると考えられ、ADによる軽度認知障害及び軽度の認知症の進行抑制が期待される。
本剤の臨床試験は、早期ADを対象とした国際共同第Ⅱ相プラセボ対照⽐較試験(⽇本⼈を含む)であるBAN2401-G000-201試験 Core Study(201試験Core Study)、早期ADを対象とした国際共同第Ⅲ相プラセボ対照⽐較試験(⽇本⼈を含む)のBAN2401-G000-301試験(Clarity AD)Core Study(301試験Core Study)、2023年9⽉時点で試験進⾏中である201試験の⾮盲検継続投与期(201試験OLE)および301試験の⾮盲検継続投与期(301試験OLE)の中間解析によって有効性、安全性が検討された。
本剤は、⽶国では2023年7⽉に承認を取得した。本邦においては上記の国際共同の臨床成績により評価され、2023年9⽉に「アルツハイマー病による軽度認知障害及び軽度の認知症の進⾏抑制」の効能又は効果で製造販売承認を取得した。
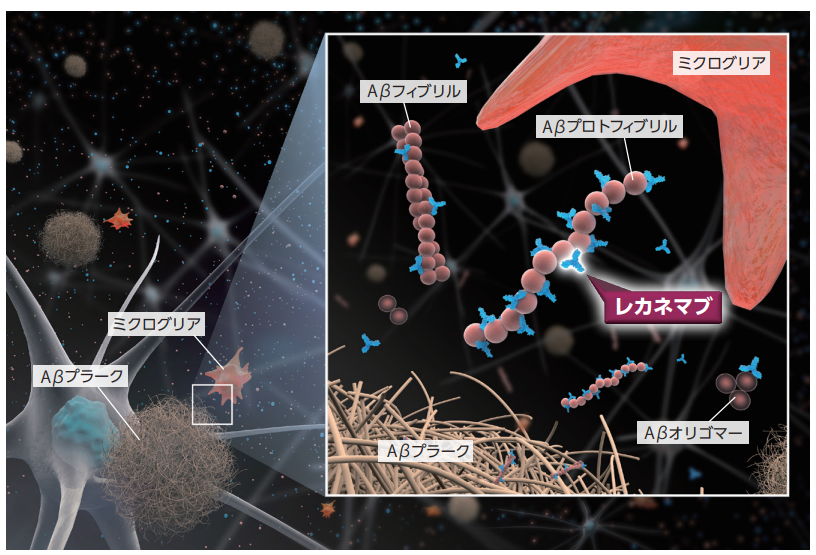
作用機序
Aβは単量体(モノマー)から、より大きなオリゴマー、プロトフィブリルおよびフィブリルへと凝集し、最終的に細 胞外でAβプラークを形成する。Aβ凝集体は神経毒性を示し、神経細胞の破壊やシナプス障害を引き起こすこ とが示唆されており、ADは脳内のAβプラークの蓄積を病理組織学的な特徴とする。 レカネマブは、ヒト化IgG1モノクローナル抗体であり、毒性が示唆されているAβプロトフィブリルに選択的に 結合するが、Aβプラークの主要構成成分であるAβフィブリルにも結合し、脳脊髄液(CSF)中への排出を介 して脳内のAβプロトフィブリルおよびAβプラークを減少させると考えられる。また、レカネマブは、ミクログリ ア細胞によるFc受容体を介したAβの食作用を促進したことから、ミクログリア細胞による食作用の活性化が 脳内Aβの減少作用に寄与すると考えられる。
製品情報
| 商品名 | レケンビ点滴静注200㎎/レケンビ点滴静注500㎎ |
| 一般名 (洋名) | レカネマブ (Lecanemab) |
| 承認年月日 | 2023年9月25日 |
| 発売年月日 | |
| メーカー | エーザイ株式会社 |
| 名前の由来 | 一般名であるレカネマブ(Lecanemab)と、健やかさ・美しさ(健美)をイメージした「QEMBI」を組み合わせて「LEQEMBI」とした。 |
| ステム |
[こちらも参照:ステムで薬の名前を暗記!【一覧リスト】薬が覚えられない人必見!]
効能又は効果
アルツハイマー病による軽度認知障害及び軽度の認知症の進行抑制
警告
・本剤の投与は、アミロイドPET、MRI等の本剤投与にあたり必要な検査及び管理が実施可能な医療施設又は当該医療施設と連携可能な医療施設において、アルツハイマー病の病態、診断、治療に関する十分な知識及び経験を有し、本剤のリスク等について十分に管理・説明できる医師の下で、本剤の投与が適切と判断される患者のみに行うこと。
・本剤の投与開始に先立ち、本剤投与によるARIA(アミロイド関連画像異常)の発現割合、ARIAのリスク及びリスク管理のために必要な検査、ARIA発現時の対処法について、患者及び家族・介護者に十分な情報を提供して説明し、同意を得てから投与すること。また、異常が認められた場合には、速やかに主治医に連絡するよう指導すること。
禁忌
・本剤の成分に対し重篤な過敏症の既往歴のある患者
・本剤投与開始前に血管原性脳浮腫が確認された患者[ARIAのリスクが高まるおそれがある。]
・本剤投与開始前に5個以上の脳微小出血、脳表ヘモジデリン沈着症又は1cmを超える脳出血が確認された患者[ARIAのリスクが高まるおそれがある。]
用法及び用量
通常、レカネマブ(遺伝子組換え)として10mg/kgを、2週間に1回、約1時間かけて点滴静注する。
注意
・本剤は、疾患の進行を完全に停止、又は疾患を治癒させるものではない。
・承認を受けた診断方法、例えばアミロイドPET、脳脊髄液(CSF)検査、又は同等の診断法によりアミロイドβ病理を示唆する所見が確認され、アルツハイマー病と診断された患者のみに本剤を使用すること。
・無症候でアミロイドβ病理を示唆する所見のみが確認できた者、及び中等度以降のアルツハイマー病による認知症患者に本剤を投与開始しないこと。
代謝・代謝酵素について
レカネマブは、ヒト化IgG1モノクローナル抗体であることから、他の免疫グロブリンG1と同様に異化作用により分解されると推察される。
食事の影響
該当データなし
副作用(抜粋)
本剤群で発現した主な副作用(発現率1%以上)は、注入に伴う反応(26.1%)、ARIA-H(16.5%)、ARIA-E(12.6%)、頭痛(1.8%)、過敏症(1.7%)であった。
本剤群における症候性ARIA-E、ARIA-Hの有害事象発現率はそれぞれ2.8%、1.4%であった。
こちらのサイトは記載日時点の添付文書、インタビューフォームをまとめたものです。記載内容には十分な注意を払っておりますが、医療の情報は日々新しくなるため、誤り等がある場合がございます。参考にする場合は必ず最新の添付文書等をご確認ください。
情報更新日:2023年12月