イプタコパン塩酸塩(販売名:ファビハルタ®カプセル)は、スイス・Novartis 社で創薬された補体 B 因子阻害剤である。イプタコパンは補体 B 因子の活性部位に結合してその活性を阻害することで、C3 転換酵素の C3 からC3bへの分解を阻害して補体第二経路の活性化を阻害する。これにより、C3の増幅回路の活性化、C3 フラグメントによる細胞のオプソニン化、並びに C5 転換酵素及び膜侵襲複合体(MAC)の形成が阻害される。イプタコパンは、PNH 型赤血球に対して MAC 形成阻害及びオプソニン化阻害により血管内溶血及び血管外溶血の両方を抑制する。
本剤の開発では、補体(C5)阻害剤投与下で活動性溶血を有する PNH 患者を対象に本剤を追加投与した外国第Ⅱ相試験(X2201 試験)、及び補体阻害剤未治療で活動性溶血を有する PNH 患者を対象とした外国第Ⅱ相試験(X2204 試験)が開始された。X2201 試験及び X2204 試験の中間解析の結果、補体(C5)阻害剤による治療歴の有無によらず、本剤 200mg1 日 2 回投与による血管内溶血及び血管外溶血の抑制が示され、安全性及び忍容性が確認された。これらの結果を踏まえ、補体(C5)阻害剤投与下で貧血を有する PNH 患者を対象に本剤へ切り替えたときの有効性及び安全性を評価する実薬対照の検証試験である国際共同第Ⅲ相試験(C12302/APPLY-PNH 試験)、補体阻害剤未治療で溶血及び貧血を有する PNH 患者を対象とする単群試験である国際共同第Ⅲ相試験(C12301/APPOINT-PNH 試験)が行われた。C12302/APPLY-PNH 試験及び C12301/APPOINT-PNH 試験の主要評価期終了時解析の結果、C12302/APPLY-PNH 試験でイプタコパン 200mg 1 日 2 回単独投与の有効性及び安全性が確認され、これと一貫性のある結果が C12301/APPOINT-PNH 試験で示された。これらのことから、米国では 2023 年 12 月、欧州では 2024 年 5月に「発作性夜間ヘモグロビン尿症」を適応症として承認を取得した。なお、本剤は欧米では 2020 年に PNH に対する希少疾病用医薬品として指定され、米国では 2020 年に Breakthrough Therapy にも指定されている。
C12302/APPLY-PNH試験には日本からも参加し、主要評価期終了時解析の結果、全体集団と日本人集団の有効性、安全性及び薬物動態に大きな違いはなかったことから、日本では 2024 年 6 月に「発作性夜間ヘモグロビン尿症」を適応症として承認された。
作用機序
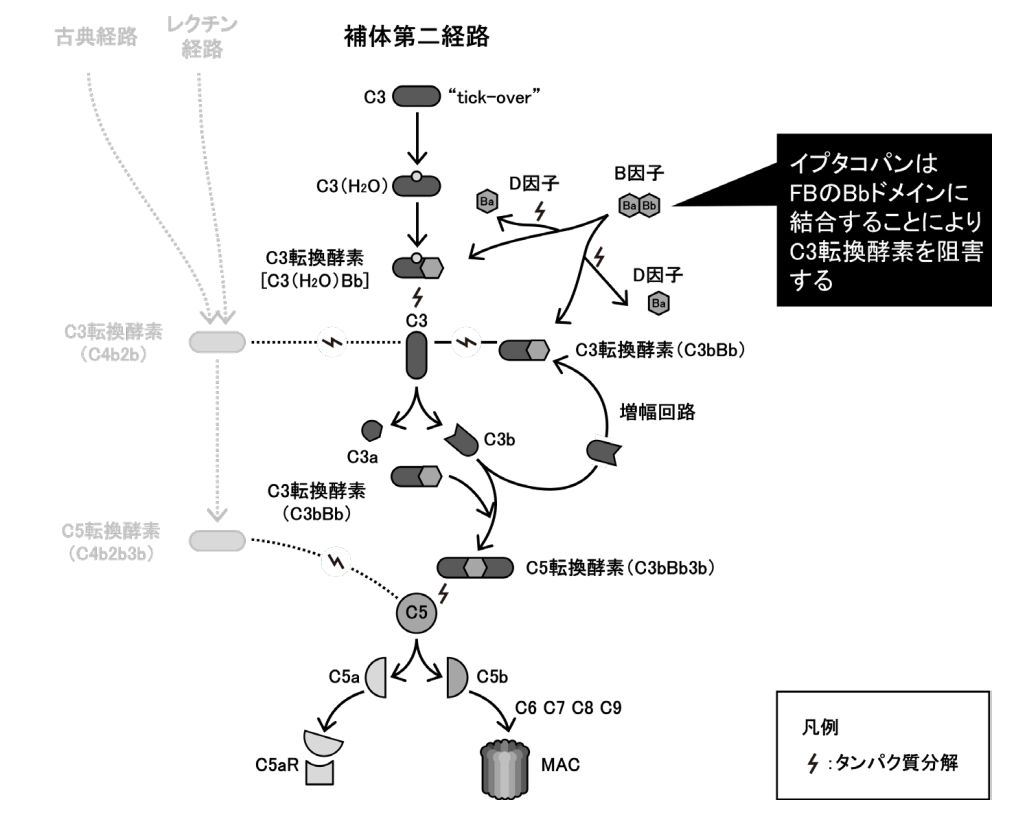
イプタコパンは、補体 B 因子(FB)を阻害する補体阻害剤である。FB は、C3及び C5 転換酵素の触媒作用に重要であり、3 つの補体活性化経路(古典経路、レクチン経路、第二経路)のうち補体第二経路の主要なプロテアーゼである。
イプタコパンは FB の活性部位に結合してその活性を阻害することで、C3 転換酵素による C3 の C3a と C3b への分解を阻害して補体第二経路の活性化を阻害する。これにより、C3 の増幅回路の活性化、C3 フラグメントによる細胞のオプソニン化、C5 転換酵素及び MAC の形成、並びにカスケード反応に伴って生じるアナフィラトキシン C3a 及び C5a の生成が阻害される。一方、イプタコパンは古典経路及びレクチン経路から合流した C3 増幅も抑制するが、これらのカスケード反応に直接影響しない。
イプタコパンは PNH 型赤血球に対し、MAC の形成を阻害することで血管内溶血を抑制し、C3フラグメントのオプソニン化を阻害することで血管外溶血を抑制すると考えられる。
製品情報
| 商品名 | ファビハルタカプセル200mg |
| 一般名 (洋名) | イプタコパン塩酸塩水和物 (Iptacopan Hydrochloride Hydrate) |
| 承認年月日 | 2024年6月24日 |
| 発売年月日 | 2024年8月15日 |
| メーカー | ノバルティスファーマ(株) |
| 名前の由来 | 補体 B 因子阻害剤(fab:factor B inhibitor)と補体第二経路(alta:alternative complement pathway)の強い関係を表している |
| ステム | 補体受容体拮抗薬/補体阻害剤:-copan |
[こちらも参照:ステムで薬の名前を暗記!【一覧リスト】薬が覚えられない人必見!]
効能又は効果
発作性夜間ヘモグロビン尿症
1.1 本剤は補体経路を阻害するため、髄膜炎菌、肺炎球菌、インフルエンザ菌等の莢膜形成細菌による重篤な感染症を発症することがあり、特に髄膜炎菌感染症は急激に重症化し、死亡に至るおそれもあるため、以下の点に十分注意すること。
1.1.1 本剤の投与に際しては、髄膜炎菌等による感染症の初期徴候(発熱、頭痛、項部硬直等)に注意して観察を十分に行い、髄膜炎菌等の重篤な感染症が疑われた場合には、直ちに診察し、抗菌剤の投与等の適切な処置を行うこと。
1.1.2 髄膜炎菌、肺炎球菌及びインフルエンザ菌b型に対するワクチンの接種歴を確認し、未接種の場合又は追加接種が必要な場合は、原則、本剤投与前にワクチンを接種すること。必要に応じて、本剤投与中のワクチンの追加接種を考慮すること。
1.1.3 髄膜炎菌感染症は致命的な経過をたどることがあるので、緊急時に十分に措置できる医療施設及び医師のもとで、あるいは髄膜炎菌感染症の診断及び治療が可能な医療施設との連携下で本剤を投与すること。
1.1.4 髄膜炎菌等の莢膜形成細菌による感染症のリスクについて患者に説明し、当該感染症の初期徴候を確実に理解させ、感染症に関連する症状が発現した場合には、主治医に連絡するよう患者に注意を与えること。
1.2 発作性夜間ヘモグロビン尿症に十分な知識を持つ医師のもとで、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、本剤投与開始に先立ち、本剤は疾病を完治させる薬剤ではないことを含め、本剤の有効性及び危険性を患者又はその家族に十分説明し、同意を得てから投与すること。
2.1 髄膜炎菌感染症に罹患している患者[症状を悪化させるおそれがある。]
2.2 肺炎球菌、インフルエンザ菌等の莢膜形成細菌による重篤な感染症に罹患している患者[症状を悪化させるおそれがある。]
2.3 本剤の成分に対し過敏症の既往歴のある患者
用法及び用量
通常、成人にはイプタコパンとして1回200mgを1日2回経口投与する。
補体(C5)阻害剤から本剤に切り替える際は、補体(C5)阻害剤の中止に伴う溶血のリスクを低減するため、前治療薬との投与間隔を考慮すること。
・エクリズマブ(遺伝子組換え)から切り替える場合、エクリズマブ(遺伝子組換え)の最終投与1週間後を目安に本剤の投与を開始すること。
・ラブリズマブ(遺伝子組換え)から切り替える場合、ラブリズマブ(遺伝子組換え)の最終投与6週間後を目安に本剤の投与を開始すること。
代謝・代謝酵素について
本剤は主にCYP2C8で代謝され、有機アニオントランスポーター(OATP)1B1及びOATP1B3の基質である。また、本剤は、CYP2C8阻害作用及びCYP3A4誘導作用を有する。
ヒト肝ミクロソーム及び組換えヒト酵素分子種を用いた in vitro 試験では速度論的解析を行った結果、イプタコパンの酸化的代謝に関与する主要な CYP分子種は CYP2C8(寄与率:98%)であり、CYP2D6(寄与率:2%)もわずかに関与することが示された。
ヒト酵素発現系(UGT 分子種)及びヒト肝ミクロソームを用いた in vitro 試験ではアシルグルクロン酸抱合代謝物(M8 及び M8c)への代謝速度とミクロソーム中の UGT 特異的マーカー酵素活性との相関を検討した結果、直接的なグルクロン酸抱合代謝に関与する主要な UGT 分子種は UGT1A1(相関係数:0.83)であることが示された。
食事の影響
健康成人(12例)に本剤100mgを空腹時及び高脂肪食摂取後に単回経口投与したとき、イプタコパンの曝露量は食事による影響を受けなかった(外国人データ)。
副作用(抜粋)
重大な副作用として、髄膜炎菌感染症、重篤な感染症が注意喚起されている。
5%以上の副作用には、血小板数減少、頭痛が報告されている。
情報更新日:2024年9月