機能性ディスペプシア(FD:functional dyspepsia)は、内視鏡などの検査で器質的疾患を認めないにもかかわらず、もたれ感や飽満感、みぞおちの痛みなどの上腹部を中心とする症状が持続する機能性疾患である。
機能性ディスペプシア患者の中には、症状の再発と消失を長期間繰り返す場合もある。また、致死的な疾患ではないものの、患者の生活の質(QOL:quality of life)に及ぼす影響は大きく、労働生産性の低下につながる重要な要因となっていることも指摘されている。
日本における機能性ディスペプシアの有病率は一般的に 10~20%と言われ、定期健診受診者を対象に行った調査では、機能性ディスペプシアの有病率は 14.1%であった 。また、胃痛や胃もたれ、胸やけなどをはじめとした上腹部愁訴の有病率を調べたところ、日本人の 4 人に 1 人は、3 ヵ月に 1 度は上腹部愁訴を経験しているという報告もある 。
これまで、機能性ディスペプシアを効能・効果とする薬剤はなく、これまで上腹部症状改善のための対症療法として消化管運動機能改善薬、ヒスタミン H2受容体拮抗薬、プロトンポンプ阻害薬などを用いた薬物治療が行われている。しかし、これら薬剤の FD に対する明確なエビデンスは確立されておらず、FD 患者の再燃と寛解を繰り返す症状の改善及び QOL の改善に明確なエビデンスに基づく有効な治療薬が求められていた。
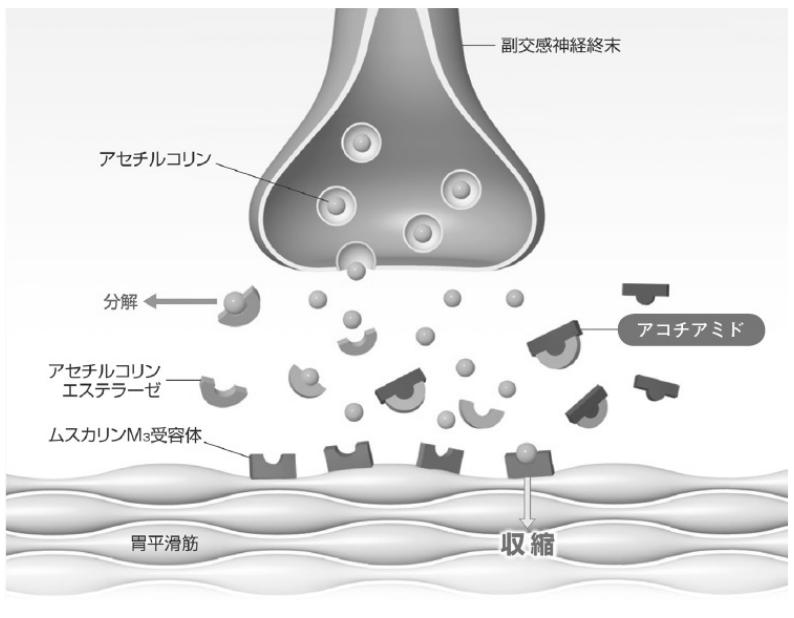
アコチアミド塩酸塩水和物(本剤)は、1990 年代後半にゼリア新薬工業株式会社にて創製されたアセチルコリンエステラーゼ(AChE)阻害薬である。アセチルコリン(ACh)はコリン作動性神経終末から遊離され、消化管平滑筋のムスカリン(主にムスカリンM3)受容体に結合することで消化管を収縮させる。遊離されたAChはAChE により速やかに分解され、これらの反応により、消化管運動が調節されると考えられている。
本剤はAChE を阻害し、副交感神経(コリン作動性神経)終末から遊離されるACh の分解を抑制する。その結果、シナプス間隙におけるACh 量を増加させると考えられ、機能性ディスペプシアの原因となる低下した胃運動及び胃排出能を改善する。そこで、2000 年より本邦での臨床試験を開始し、第Ⅲ相臨床試験及び長期投与臨床試験にて国際的な診断基準であるRomeⅢ基準に基づくFD 患者を対象に有効性及び安全性を確認した。これらの結果をもって2010 年9 月に承認申請を行い、2013 年3 月に、「機能性ディスペプシ
アにおける食後膨満感、上腹部膨満感、早期満腹感」を効能・効果として承認された。
作用機序
消化管は、副交感神経(コリン作動性神経)終末から遊離された ACh が胃平滑筋のムスカリン(主にムスカリン M3)受容体に結合することで収縮する。一方で、ACh は AChE により分解され、これらの反応により、消化管運動が調節されると考えられている。
本剤は、AChE を阻害する。その結果、副交感神経終末から遊離される ACh の分解を抑制することで、シナプス間隙における ACh 量を増加させると考えられ、機能性ディスペプシアの原因となる低下した胃運動および胃排出能を改善する。
製品情報
| 商品名 | アコファイド錠 |
| 一般名 (洋名) | アコチアミド (Acotiamide) |
| 発売年月日 | 2013年 6月 |
| メーカー | ゼリア新薬工業株式会社 |
| ステム | なし |
[こちらも参照:ステムで薬の名前を暗記!【一覧リスト】薬が覚えられない人必見!]
効能又は効果
機能性ディスペプシアにおける食後膨満感、上腹部膨満感、早期満腹感
用法及び用量
通常、成人にはアコチアミド塩酸塩水和物として1回100mgを1日3回、食前に経口投与する。
・症状が持続する場合は器質的疾患の可能性も考慮し、上部消化管内視鏡検査に加え、必要に応じて他の検査の実施を検討すること。
代謝・代謝酵素について
ヒト CYP 又は UGT 発現系ミクロソームによる in vitro 代謝試験において、アコチアミドは CYP2C8、CYP1A1 又は CYP3A4 によって脱イソプロピル化され、抱合反応は主に UGT1A8 及び 1A9 が関与することが示された。
食事の影響
健康成人男性に本剤 1 回 1 錠(アコチアミド塩酸塩水和物として 100mg)を空腹時、食前又は食後に経口投与したとき、Cmax は食前投与で最も高く、空腹時投与に比べ 62.7%上昇した。また、食後投与の Cmaxは食前投与の 59.6%であった。AUC last は、食後投与で最も低く、空腹時及び食前投与に比べそれぞれ
76.8%及び 80.0%に減少した。
副作用(抜粋)
国内臨床試験において安全性の評価対象 1,125 例中 183 例(16.3%)に副作用(臨床検査値異常を含む)がみられた。主な副作用は下痢(2.1%)、便秘(1.6%)、悪心(0.8%)、嘔吐(0.5%)であった。
臨床検査値異常は血中プロラクチン増加(3.6%)、ALT(GPT)増加(1.8%)、γ-GTP 増加(1.2%)、血中トリグリセリド増加(1.0%)、AST(GOT)増加(1.0%)、血中ビリルビン増加(0.7%)、白血球数増加(0.5%)、血中 ALP増加(0.5%)であった(承認時)。