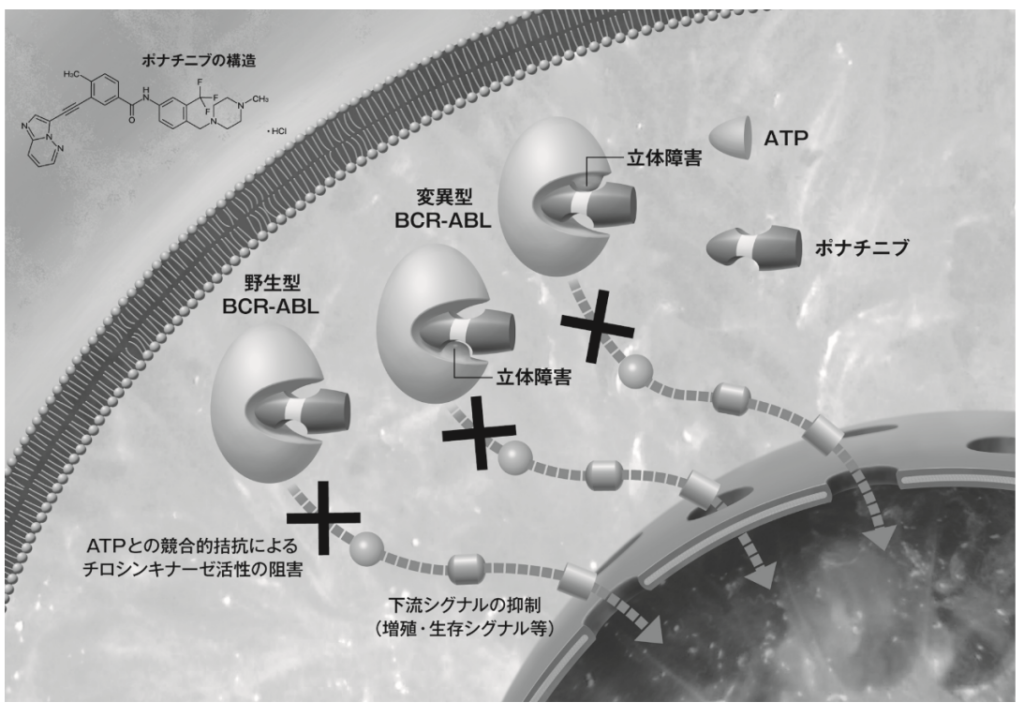
アイクルシグ錠(一般名:ポナチニブ塩酸塩・以下ポナチニブ)は、最新のコンピューター技術を活用して米国 ARIAD 社が開発した、チロシンキナーゼ阻害薬(以下、TKI)です。ポナチニブはその構造に炭素間三重結合を有する新規化合物であり、BCR-ABL にアミノ酸 1 残基の変異が存在しても、活性部位への結合阻害が生じにくいように設計された TKI です。
慢性骨髄性白血病(CML)及びフィラデルフィア染色体陽性急性リンパ性白血病(Ph+ALL)の治療には、TKI が広く使用されています。しかし、一部の患者では既存の TKI が無効であり、第二世代 TKI に抵抗性又は不耐容となった場合の治療選択肢は限られていました。
ポナチニブの海外第 II 相試験はダサチニブ又はニロチニブに抵抗性又は不耐容、もしくは T315I 変異を有する CML 患者及び Ph+ALL 患者を対象に行われ、これらの患者に対する有用性が確認されたことから、米国では 2012 年 12 月に、欧州では 2013 年 6 月に承認されました。米国において承認後、本剤投与による血管閉塞性事象の発現リスクが明らかになったことを踏まえ、一時的に本剤の販売が中止しました。当該事象に対する添付文書の改訂及びリスク評価、リスク緩和戦略(Risk Evaluation and Mitigation Strategies:REMS)の策定等の安全性確保の方策を実施することで、本剤の販売が再開されました。
一方、日本においては、ダサチニブ又はニロチニブに抵抗性又は不耐容である CML、もしくは TKI による前治療に抵抗性又は不耐容である Ph+ALL 患者を対象に国内第 I/II 相試験が行われ、海外第Ⅱ相試験と同様の有用性が確認されたことより、血管閉塞性事象等の有害事象の安全管理対策を徹底させることで、アイクルシグ錠 15mg は、2016 年 9 月に「前治療薬に抵抗性又は不耐容の慢性骨髄性白血病」並びに「再発又は難治性のフィラデルフィア染色体陽性急性リンパ性白血病」を効能・効果として、製造販売承認を取得しました。
作用機序
ポナチニブは、コンピューターを活用したレセプタータンパク質とリガンドの相互作用解析に基づく分子設計創薬により ARIAD 社が開発した、経口breakpoint cluster region–abelson(BCR-ABL)阻害薬である。BCR-ABL は、慢性骨髄性白血病(CML)及びフィラデルフィア染色体陽性急性リンパ性白血病(Ph+ALL)の発症原因となる異常なチロシンキナーゼであり、ポナチニブは野生型BCR-ABL 及び他の治療薬に対して抵抗性となる変異型 BCR-ABL を含む、あらゆる BCR-ABL に対し阻害作用を示す。
In vitro において、野生型 ABL 及び T315I 変異型 ABL の in vitro チロシンキナーゼ活性を阻害する(IC50 値はそれぞれ 0.4 及び 2.0 nM)。また、チロシンキナーゼである RET、FLT3、KIT 及び FGFR、PDGFR、VEGFR、EPH などの各増殖因子受容体ファミリー及び SRC ファミリーキナーゼのそれぞれ野生型及び各種変異体に対して in vitro キナーゼ活性阻害を示した(IC50値は 20 nM 以下)。
製品情報
| 商品名 | アイクルシグ錠15mg |
| 一般名 (洋名) | ポナチニブ塩酸塩 (Ponatinib Hydrochloride) |
| 発売年月日 | 2016年 11月 21日 |
| メーカー | 大塚製薬株式会社 |
| 名前の由来 | inclusive(すべてを含んだ、包括的な)に由来する。 |
| ステム | チロシンキナーゼインヒビター:-tinib |
[こちらも参照:ステムで薬の名前を暗記!【一覧リスト】薬が覚えられない人必見!]
効能又は効果
・前治療薬に抵抗性又は不耐容の慢性骨髄性白血病
・再発又は難治性のフィラデルフィア染色体陽性急性リンパ性白血病
・本剤は、緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に対して十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与すること。また、本剤による治療開始に先立ち、患者又はその家族に有効性及び危険性を十分に説明し、同意を得てから投与を開始すること。
・心筋梗塞、脳梗塞、網膜動脈閉塞症、末梢動脈閉塞性疾患、静脈血栓塞栓症等の重篤な血管閉塞性事象があらわれることがあり、死亡に至った例も報告されている。本剤の投与開始前に、虚血性疾患(心筋梗塞、末梢動脈閉塞性疾患等)、静脈血栓塞栓症等の既往歴の有無、心血管系疾患の危険因子(高血圧、糖尿病、脂質異常症等)の有無等を確認した上で、投与の可否を慎重に判断すること。また、本剤投与中は患者の状態を十分に観察し、胸痛、腹痛、四肢痛、片麻痺、視力低下、息切れ、しびれ等の血管閉塞性事象が疑われる徴候や症状の発現に注意すること。
・重篤な肝機能障害があらわれることがあり、肝不全により死亡に至った例も報告されているので、本剤投与開始前及び投与中は定期的に肝機能検査を行い、患者の状態を十分に観察すること。
・本剤の成分に対し過敏症の既往歴のある患者
・妊婦又は妊娠している可能性のある女性
用法及び用量
通常、成人にはポナチニブとして45mgを1日1回経口投与する。なお、患者の状態により適宜減量する。
・血管閉塞性事象又はGrade 3以上の心不全が発現した場合は、直ちに本剤を投与中止すること。なお、副作用が消失し、治療継続が患者にとって望ましいと判断された場合は、本剤投与を再開できるが、再開する際には、本剤の減量を考慮すること。
・血管閉塞性事象及びGrade 3以上の心不全以外の副作用が発現した場合には、添付文書等記載の基準を参考に、本剤を休薬、減量又は投与中止すること。
代謝・代謝酵素について
ポナチニブは主に肝臓及び消化管において代謝される。
ポナチニブは、主に CYP3A4 により代謝され、CYP2D6、CYP2C8 及び CYP3A5 によっても一部代謝される(in vitro)。また、主に消化管のエステラーゼ/アミダーゼにより加水分解を受け、血漿中主要代謝物である AP24600 が生成されるものと考えられる。
食事の影響
健康被験者に本剤 45mg を単回経口投与したとき、空腹時に比べて標準高脂肪食(約 900~1,000kcal、脂肪 500~600kcal)摂取後では、Cmax 及び AUC はそれぞれ 0.94 倍及び 1.1 倍であった。また、健康被験者に本剤 45mg を単回経口投与したとき、空腹時に比べて標準低脂肪食(約547kcal、脂肪 63kcal)摂取後では、Cmax及び AUC はそれぞれ 0.94 倍及び 0.98 倍であった。
副作用(抜粋)
重大な副作用として冠動脈疾患(3.8%)、脳血管障害(2.9%)、末梢動脈閉塞性疾患(2.7%)、静脈血栓塞栓症(1.7%)、骨髄抑制(48.8%)、高血圧(14.1%)、肝機能障害(17.5%)、膵炎(6.1%)、体液貯留(11.6%)、感染症(12.4%)、重度の皮膚障害(1.7%)、出血(2.3%)、心不全(1.9%)、不整脈(4.6%)、腫瘍崩壊症候群(0.2%)、ニューロパチー(3.2%)、肺高血圧症(1.3%)があらわれることがあります。
その他、頻度の多い(10%以上)副作用として、頭痛、腹痛、便秘、悪心、発疹、皮膚乾燥、筋肉痛、関節痛、リパーゼ増加、疲労、発熱が報告されています。
情報更新日:2022年1月