開発の経緯について
ロナプリーブ(以下、本剤)は、2019 年 12 月に中華人民共和国で確認された SARS-CoV-2 による感染症(COVID-19)の世界的流行を受け、米国のRegeneron 社が創製した、完全ヒト IgG1モノクローナル抗体である。
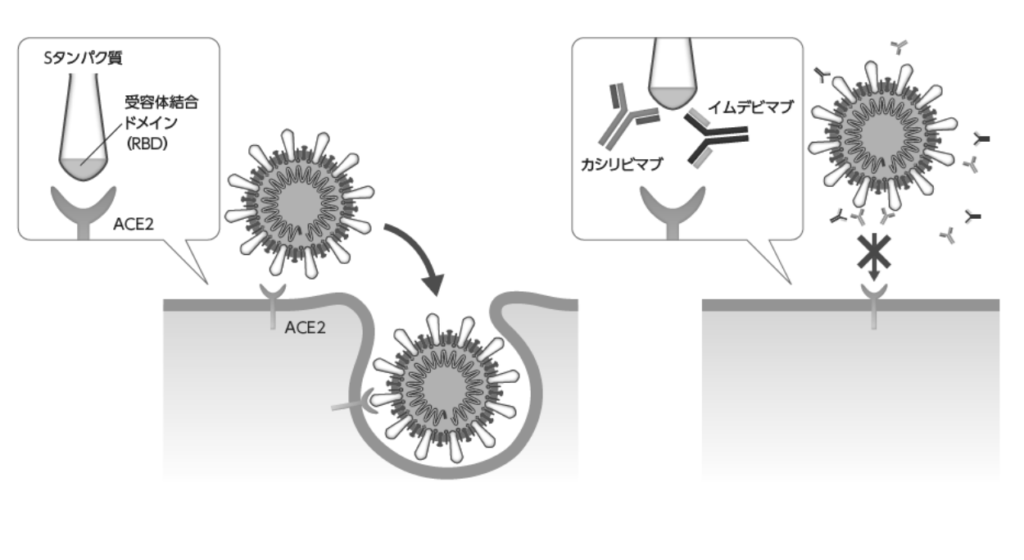
本剤は、SARS-CoV-2 のスパイク糖タンパク質(以下、S タンパク質)に対する中和抗体カシリビマブ及びイムデビマブ 2 種類を同時に投与する抗体カクテル療法であり、SARS-CoV-2 の宿主細胞への侵入を阻害することにより、ウイルスの増殖を抑制すると考えられている。
海外では SARS-CoV-2 による感染症患者を対象とした複数の臨床試験が実施され、このうち、SARS-CoV-2 ウイルス検査陽性外来患者を対象とした海外第Ⅰ/Ⅱ/Ⅲ相試験である COV-2067 試験の中間解析結果 2)に基づき、米国においては、2020 年 11 月 21 日に Emergency Use Authorization(緊急使用許可)が認められた。
2020 年 12 月、中外製薬は本邦における販売・開発実施権に関する契約をRegeneron 社と共同で製造・開発を進めていた Roche 社と締結し、2021 年 3 月から日本人成人被験者(SARS-CoV-2による感染症ではない被験者)を対象に、本剤の日本人での安全性・忍容性及び薬物動態を評価することを主目的とした JV43180 試験を実施した。
COV-2067 試験及び JV43180 試験の成績に基づき、2021 年 6 月 29 日、中外製薬は「SARSCoV-2 による感染症」を効能又は効果とした医薬品製造販売承認申請を行い、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)」に基づく特例承認制度により、本剤は 2021 年 7 月 19 日に特例承認が認められた。
特例承認後、本剤は中外製薬から厚生労働省に提供され、厚生労働省に帰属のもと、「ロナプリーブ登録センター」を通じて、全国の対象医療機関に配分され、投与対象となる患者への治療に使用されている。
さらに、国内における感染拡大に対応するために医療提供体制の拡充が求められるなか、2021年 10 月 11 日には、海外で実施された COV-2069 試験及びCOV-20145 試験の結果を基に、「SARSCoV-2 による感染症の発症抑制」と「単回皮下注射※」の医薬品製造販売承認申請を行い、2021 年11 月に、新たな「効能又は効果」・「用法及び用量」においても特例承認が認められた。
作用機序
カシリビマブ及びイムデビマブは、SARS-CoV-2 ウイルスの S タンパク質を認識し、SARS-CoV2 の宿主細胞への侵入を阻害することにより、ウイルスの増殖を抑制すると考えられている。また、カシリビマブ及びイムデビマブは SARS-CoV-2 ウイルスの S タンパク質に対して異なる部位を認識する。
製品情報
| 商品名 | ロナプリーブ注射液セット300 ロナプリーブ注射液セット1332 |
| 一般名 (洋名) | カシリビマブ、イムデビマブ (Casirivimab、Imdevimab) |
| 発売年月日 | 2021 年 7 月 22 日 |
| メーカー | 中外製薬株式会社 |
| 名前の由来 | a rePRiEVE from coRONA に由来する。 |
| ステム | 抗ウイルスモノクローナル抗体:-vimab |
[こちらも参照:ステムで薬の名前を暗記!【一覧リスト】薬が覚えられない人必見!]
効能又は効果
SARS-CoV-2による感染症及びその発症抑制
2021.12添付文書改訂時に追加:
omicron株(B.1.1.529系統)については、本剤の有効性が減弱するおそれがあることから、厚生労働省の事務連絡等に基づき、適切な患者に対して投与すること。
警告
〈SARS-CoV-2による感染症の発症抑制〉
SARS-CoV-2による感染症の予防の基本はワクチンによる予防であり、本剤はワクチンに置き換わるものではない。
禁忌
本剤の成分に対し重篤な過敏症の既往歴のある患者
用法及び用量
通常、成人及び12歳以上かつ体重40kg以上の小児には、カシリビマブ(遺伝子組換え)及びイムデビマブ(遺伝子組換え)としてそれぞれ600mgを併用により単回点滴静注又は単回皮下注射する。
注意
〈SARS-CoV-2による感染症〉
・SARS-CoV-2による感染症の症状が発現してから速やかに投与すること。臨床試験において、症状発現から8日目以降に投与を開始した患者における有効性を裏付けるデータは得られていない。
・点滴静注により投与すること。点滴静注による投与が実施できずやむを得ない場合にのみ皮下注射による投与を検討すること。臨床試験において皮下注射による投与時の有効性は確認されていない。
〈SARS-CoV-2による感染症の発症抑制〉
・本剤の投与が適切と判断された後に速やかに投与すること。
・投与後30日目以降の有効性を裏付けるデータは得られていない。
代謝・代謝酵素について
該当資料なし
食事の影響
該当資料なし
副作用(抜粋)
重大な副作用として、重篤な過敏症、infusion reaction があらわれることがある。また、主な副作用として注射部位反応が報告されている。
こちらのサイトは記載日時点の添付文書、インタビューフォームをまとめたものです。記載内容には十分な注意を払っておりますが、医療の情報は日々新しくなるため、誤り等がある場合がございます。参考にする場合は必ず最新の添付文書等をご確認ください。
情報更新日:2022年2月